ВОДОРОДНАЯ И КИСЛОРОДНАЯ КОРРОЗИЯ
Коррозия металлов часто подразделяется на водородную и кислородную.
Если происходит восстановление ионов H3O+ или молекул воды H2O, говорят о водородной коррозии, или коррозии с водородной деполяризацией. Восстановление ионов происходит по следующей схеме:

Если водород не выделяется, что часто происходит в нейтральной или сильнощелочной среде, происходит восстановление кислорода и возникает кислородная коррозия, или коррозия с кислородной деполяризацией:
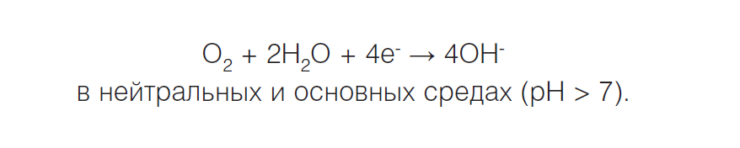
Коррозионный элемент может образовываться не только при соприкосновении двух различных металлов, но и в случае использования одного металла, если, к примеру, структура его поверхности неоднородна.
Исходя из того, что возникновение коррозии возможно только при уменьшении энергии поверхностных сил в том или другом материале, возможность коррозии с водородной и кислородной деполяризацией может быть установлена с помощью формулы, связывающей энергию Гиббса и напряжение гальванического элемента:
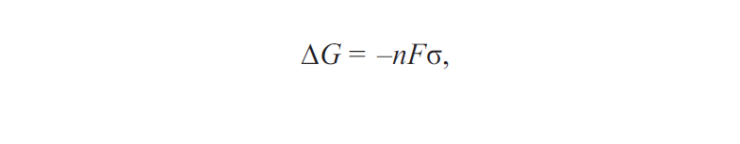
где G — энергия Гиббса; n — напряжение гальванического элемента; F — площадь гальванического элемента; σ — коэффициент, зависящий от материала гальванического элемента.
Коррозия возможна при условии, если ΔG < 0.
В зависимости от величины потенциала металла по отношению к потенциалу водородного или кислородного электрода, металлы можно разделить на три группы.
Если потенциал металла отрицательнее потенциала водородного электрода, то возможна коррозия как с поглощением кислорода, так и с выделением водорода. К таким металлам относятся щелочные и щелочноземельные металлы: Al, Zn и др.
Если потенциал металла положительнее потенциала водородного электрода и отрицательнее потенциала кислородного электрода, то коррозия возможна с поглощением кислорода и невозможна с выделением водорода. К этим металлам относятся Cd, Ni, Sn и др. Если потенциал металла положительнее потенциа ла кислородного электрода, то коррозия металла невозможна. Это — благородные металлы, например Au, Ag, Pt.
Виды коррозии
Как уже говорилось, критериев классификация коррозионных процессов существует множество. Так, различают коррозию по виду распространения (сплошная, местная), по типу коррозионной среды (газовая, атмосферная, жидкостная, почвенная), по характеру механических воздействий (коррозионное растрескивание, явление Фреттинга, кавитационная коррозия) и так далее.
Но основным способом классификации коррозии, позволяющим наиболее полно объяснить все тонкости этого процесса, является классификация по механизму протекания.
По этому критерию различают два вида коррозии:
- химическую
- электрохимическую
Химическая коррозия
Химическая коррозия отличается от электрохимической тем, что протекает в средах, не проводящих электрический ток. Поэтому при такой коррозии разрушение металла не сопровождается возникновением электрического тока в системе. Это обычное окислительно-восстановительное взаимодействие металла с окружающей средой.
Наиболее типичным примером химической коррозии является газовая коррозия. Газовую коррозию еще называют высокотемпературной, поскольку обычно она протекает при повышенных температурах, когда возможность конденсации влаги на поверхности металла полностью исключена. К такому виду коррозии можно отнести, например, коррозию элементов электронагревателей или сопел ракетных двигателей.

Скорость химической коррозии зависит от температуры — при ее повышении коррозия ускоряется. Из-за этого, например, в процессе производства металлического проката, во все стороны от раскаленной массы разлетаются огненные брызги. Это с поверхности металла скалываются частички окалины.
Окалина — типичный продукт химической коррозии, — оксид, возникающий в результате взаимодействия раскаленного металла с кислородом воздуха.

Помимо кислорода и другие газы могут обладать сильными агрессивными свойствами по отношению к металлам. К таким газам относятся диоксид серы, фтор, хлор, сероводород. Так, например, алюминий и его сплавы, а также стали с высоким содержанием хрома (нержавеющие стали) устойчивы в атмосфере, которая содержит в качестве основного агрессивного агента кислород. Но картина кардинально меняется, если в атмосфере присутствует хлор.
В документации к некоторым антикоррозионным препаратам химическую коррозию иногда называют «сухой», а электрохимическую — «мокрой». Однако химическая коррозия может протекать и в жидкостях. Только в отличие от электрохимической коррозии эти жидкости — неэлектролиты (т.е. не проводящие электрический ток, например спирт, бензол, бензин, керосин).
Примером такой коррозии является коррозия железных деталей двигателя автомобиля. Присутствующая в бензине в качестве примесей сера взаимодействует с поверхностью детали, образуя сульфид железа. Сульфид железа очень хрупок и легко отслаивается, освобождая свежую поверхность для дальнейшего взаимодействия с серой. И так, слой за слоем, деталь постепенно разрушается.
Электрохимическая коррозия
Если химическая коррозия представляет собой не что иное, как простое окисление металла, то электрохимическая — это разрушение за счет гальванических процессов.
В отличие от химической, электрохимическая коррозия протекает в средах с хорошей электропроводностью и сопровождается возникновением тока. Для «запуска» электрохимической коррозии необходимы два условия: гальваническая пара и электролит.
В роли электролита выступает влага на поверхности металла (конденсат, дождевая вода и т.д.). Что такое гальваническая пара? Чтобы понять это, вернемся к ряду активности металлов.

Смотрим. Cлева расположены более активные металлы, справа — менее активные.
Если в контакт вступают два металла с различной активностью, они образуют гальваническую пару, и в присутствии электролита между ними возникает поток электронов, перетекающих от анодных участков к катодным. При этом более активный металл, являющийся анодом гальванопары, начинает корродировать, в то время как менее активный коррозии не подвергается.
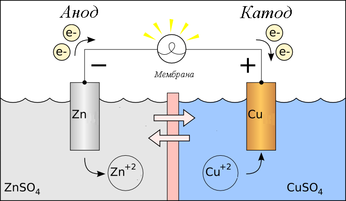 Схема гальванического элемента
Схема гальванического элемента
Для наглядности рассмотрим несколько простых примеров.
Допустим, стальной болт закреплен медной гайкой. Что будет корродировать, железо или медь? Смотрим в ряд активности. Железо более активно (стоит левее), а значит именно оно будет разрушаться в месте соединения.
 Стальной болт — медная гайка (корродирует сталь)
Стальной болт — медная гайка (корродирует сталь)
А если гайка алюминиевая? Снова смотрим в ряд активности. Здесь картина меняется: уже алюминий (Al), как более активный металл, будет терять электроны и разрушаться.
Таким образом, контакт более активного «левого» металла с менее активным «правым» усиливает коррозию первого.
Коррозионные карты России
Время, за которое происходит коррозия, непосредственно связано с вредными примесями в атмосфере.
Особенно ускоряют ее соединения серы. Основной источник выбросов серы в атмосферу — не транспорт, как думают многие, а топливная энергетика. На втором месте идет металлургия, особенно цветная, и на третьем — нефтепереработка.
Вот наглядный пример: в середине 90-ых годов XX века, когда работа многих промышленных предприятий была приостановлена, в районе завода им. Лихачева — знаменитый ЗИЛ в Москве, коррозионные потери стали и цинка уменьшились в 5 раз по сравнению с тем, что было в 50-е годы.
По тому, с какой скоростью разрушаются металлы, можно делать выводы о чистоте воздуха. И с 50-х годов прошлого века, когда во всем мире заговорили о загрязнении атмосферы, началось активное изучение коррозии. В том числе создание коррозионных карт, с помощью которых можно будет судить об изменениях в атмосфере.
В России такие работы проводятся в Институте физической химии и электрохимии им. Фрумкина.
Атмосферная коррозия — настолько сложный процесс, что его невозможно ни смоделировать в лаборатории, ни просимулировать на компьютере. Изучением атмосферной коррозии занимаются на коррозионных станциях, где под открытым небом лежат и «ржавеют» многочисленные образцы.
Процесс наблюдения и снятия показаний автоматизировать тоже не удается. Наблюдения нужно проводить годами в одних и тех же местах. За какими-то образцами достаточно наблюдать раз в месяц, а за другими сначала надо следить каждый час, а позже достаточно раз в несколько дней.

коррозия 2

коррозия

коррозия 3
Коррозионная станция Института физической химии и электрохимии в Подмосковье
В институте работают четыре коррозионные станции — в Москве (городская), в Подмосковье (сельская), в Мурманске (северная) и на Дальнем Востоке (приморская). Все это — разная влажность, разный температурный режим, разная загрязненность атмосферы и, следовательно, разная скорость коррозии.
Чтобы увеличить количество точек наблюдения, институт приглашает к сотрудничеству школьников. Сейчас при школе в поселке Старая Майна Ульяновской области строится коррозионная станция. По присланным из института чертежам школьники самостоятельно смонтировали стенды, и в ближайшее время туда завезут образцы. На коррозионной карте России появится еще одна точка.
Химические покрытия
Относятся к методам временной антикоррозионной защиты стали, например, во время пластического деформирования при повышенных температурах. Наибольшее распространение получили технологии фосфатирования и оксалатирования.
При фосфатировании поверхность покрывают сплошным слоем фосфатных солей железа и марганца, а при оксалатировании – водорастворимыми солями щавелевой кислоты. Фосфатирование используется для обработки нелегированных сталей, оксалатирование – легированных. Покрытие прочно сцепляется с поверхностью, способствуя снижению трения и уменьшению износа инструмента. После окончания штамповки покрытие удаляют.
Применение защитных покрытий и покраска
Для предотвращения коррозии металлов широко применяются различные защитные покрытия и покраска. Они помогают сохранить металлические изделия от воздействия агрессивных сред и увеличить их срок службы.
Одним из наиболее распространенных способов защиты металлов от коррозии является нанесение защитных покрытий. Это могут быть пленки, покрытия, состоящие из специальных смол или полимеров, или металлические покрытия, такие как цинковое или хромированное покрытия.
Для надежной защиты металлов от коррозии часто используют метод покраски. Покраска представляет собой нанесение красящего вещества на поверхность металла с помощью кисти, распылителя или погружения изделия в красящий состав. При этом красящий состав может содержать добавки, улучшающие адгезию и защитные свойства покрытия.
Покраска имеет ряд преимуществ перед другими методами защиты. Во-первых, она обеспечивает равномерное покрытие по всей поверхности металла, защищая его от контакта с агрессивными средами. Во-вторых, покраска позволяет легко и быстро обновить защитное покрытие, если оно стареет или повреждается. В-третьих, покраска может быть сделана в различных цветах, что позволяет не только защитить металл, но и придать ему эстетическую привлекательность.
При выборе метода защиты металлов от коррозии необходимо учитывать его условия эксплуатации и требования к долговечности покрытия
Также важно правильно подготовить и очистить поверхность металла перед нанесением защитных покрытий или покраской для обеспечения максимальной эффективности и прочности покрытия
Коррозия некоторых металлов
Коррозия меди
Одним из ключевых химических элементов для отечественной промышленности является медь. Металл также подвержен деструкции, как и другие металлические поверхности, хотя медь больше защищена от коррозии.

Даже столь стойкий к разрушениям элемент подвержен негативным изменениям при воздействии окружающей среды. Коррозия меди имеет высокий показатель ухудшения свойств металла в аэрированных растворах, содержащих ионы, образовывающие комплексы с красным металлом, окислительных кислотах.
Медь стабильна в следующих условиях:
- в атмосферной среде;
- в морской и пресной водах;
- контактируя с галогенами в специальных условиях;
- в кислотах-неокислителях, слабых растворах Н3РО4, Н2SO4.
Медь нестабильна в следующих условиях:
- в ряде соединений серы, в том числе сероводороде, чистой сере;
- в кислотах-окислителях, аэрированной неокислительной среде, концентрате Н2SO4, например:
- растворах солей-окислителей тяжелых металлов, как то Fe2(SO4)3, FeCl3;
- агрессивной воды, аэрированной воды;
- амина, NH4OH.
Атмосферная коррозия меди:
2Cu+H2O+CO2+O2→ CuCO3*Cu(OH)2
Коррозия железа
Еще один распространенный элемент, подверженный ржавлению от коррозии – железо. Наибольший процент реакций по возникновению ржи на железе припадает на реакции по его окислению воздухом или кислотами из растворов.

При химической коррозии электроны переходят на окислитель, окисление металлов показано наглядно:
3Fe+2O2→Fe3O4
Электрохимическая коррозия протекает в условиях токовой проводимости. Пример атмосферной и грунтовой реакции:
Fe+O2+H2O→Fe2O3∙xH2O
Экономические последствия коррозии в глобальном масштабе
Коррозия – глобальная проблема. По-прежнему регистрируются смертельные случаи, экономические потери и экологические последствия, вызванные коррозией материалов. Коррозия может привести к серьезным поломкам сосудов высокого давления, деталей самолетов или тягового оборудования.
Как сообщает Мухаммад А Джафар Мазумдер в статье «Global Impact of Corrosion: Occurrence, Cost and Mitigation (2020)» (Глобальное воздействие коррозии: возникновение, стоимость и смягчение последствий), типичные расходы на техническое обслуживание, связанные с проблемами коррозии для страны, варьируются от 1 до 5% от ее валового внутреннего продукта. В 2013 году организация NACE International провела глобальное исследование экономических последствий коррозии
Его целью было показать, насколько важно интегрировать антикоррозийную технологию в системы управления. В опубликованном отчете затраты на коррозию оцениваются в 2,5 трлн
$, т.е. 3,4% ВВП, а это означает, что ежегодно страны во всем мире должны выделять в бюджет значительные суммы для борьбы с коррозионным процессом.
https://irispublishers.com/gjes/fulltext/global-impact-of-corrosion-occurrence-cost-and-mitigation.ID.000618.php
Контроль и обслуживание защитных мероприятий
Проведение регулярного контроля и обслуживания защитных мероприятий является одной из важных задач, направленных на предотвращение коррозии металлов. Это позволяет сохранить эффективность и длительность использования защитных покрытий и систем, а также обнаруживать и устранять проблемы своевременно.
Важным аспектом контроля является систематическая проверка состояния защитного покрытия. Для этого используются различные методы, включая визуальный осмотр, измерение толщины покрытия с помощью специальных приборов, а также проведение химических или физических тестов для определения его стойкости и адгезии к металлической поверхности.
Также необходимо проводить регулярное обслуживание защитных систем. Это включает проверку и очистку дренажных систем, обнаружение и исправление возможных повреждений, связанных с воздействием влаги и агрессивных сред, а также замену или ремонт компонентов, которые могут быть вышедшими из строя.
Для эффективного контроля и обслуживания защитных мероприятий рекомендуется создать единый план обслуживания, который будет определять расписание проверок и обслуживания, а также списки проверяемых параметров и конкретные действия при обнаружении проблем. Это поможет обеспечить систематичность и своевременность проведения необходимых мероприятий для предотвращения коррозии металлов.
Информация о проведенных контрольных работах и обслуживании должна фиксироваться и храниться в специальной документации. Это позволит в случае необходимости провести анализ состояния защитных мероприятий на протяжении времени, а также предоставить информацию о выполненных работах при прохождении проверок или аудитов со стороны соответствующих организаций.
Деполяризация.
При наличии в растворе газообразного кислорода и не возможностью протекания процесса коррозии с водородной деполяризацией основную роль деполяризатора исполняет кислород коррозионные процессы, у которых катодная деполяризация осуществляется растворенным в электролите кислородом, называют процессами коррозии металлов с кислородной деполяризацией. Это наиболее распространенный тип коррозии металла в воде, в нейтральных и даже в слабокислых солевых растворах, в морской воде, в земле, в атмосфере воздуха.
Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой Р=0,21 атм. Следовательно, при определении термодинамической возможности протекания коррозионного процесса с кислородной деполяризацией следует производить учитывая реальное парциальное давление кислорода в воздухе (см. табл.). Т.к. значения (V ) очень положительны, то условия соблюдаются в очень многих случаях. В следующей таблице приведены значения ЭДС и изменения изобарно-изотермических потенциалов коррозионных процессов с кислородной деполяризацией:
Изучение восстановления кислорода на неблагородных металлах (а именно они представляют наибольший интерес с точки зрения коррозии) затрудняется тем, что при катодной поляризации электрода металл может иметь потенциал более положительный, чем равновесный и, следовательно, подвергается окислению (ионизации).
При катодной поляризации в определенном интервале потенциалов будут происходить одновременно два процесса восстановление кислорода и окисление металла. Окисление металла прекратится когда потенциал металла будет равен или станет отрицательнее равновесного потенциала металла. Эти обстоятельства затрудняют изучение процессов кислородной деполяризации.
Список используемой литературы
1. Исаев «Коррозия металлов»
2. Жук «Курс коррозии и защиты металлов»
Виды
Коррозия классифицируется по нескольким признакам. Классификация приведена в таблице.
|
Признак |
Вид |
Описание |
|
Участки поражения |
Равномерная |
Захватывает всю металлическую поверхность |
|
Язвенная (местная) |
Охватывает часть поверхности |
|
|
Точечная (питтинг) |
Глубоко поражает отдельные участки |
|
|
Механизм протекания |
Химическая |
Протекает под действием химических веществ в отсутствии электролитов. Может происходить на воздухе (газовая коррозия) и в водной среде (жидкостная коррозия). Под действием коррозионной среды металл окисляется, на поверхности образуются сульфидные, оксидные и другие плёнки, а коррозионные вещества восстанавливаются. Выделяют кислородную химическую коррозию и водородную деполяризацию |
|
Электрохимическая |
Протекает в присутствии электролита – проводящего ток вещества в растворах или в расплавах. Может происходить в грунте, море, атмосфере. Состоит из анодного и катодного процессов, взаимосвязанных между собой и протекающих одновременно. При анодном процессе металл окисляется, при катодном происходит восстановление окислителя, находящегося в растворе (расплаве) |
|
|
Тип агрессивной среды |
Атмосферная |
Происходит во влажной атмосфере |
|
Газовая |
Протекает в отсутствии влаги |
|
|
Грунтовая |
Происходит в кислых и щелочных почвах |
|
|
Жидкостная |
Протекает в жидкой среде |
|
|
Радиационная |
Воздействие радиоактивных веществ |
|
|
Контактная |
Соприкосновение двух металлов во влажной среде |
|
|
Биокоррозия |
Влияние живых организмов. Продукты жизнедеятельности бактерий окисляют и разрушают металл |
Если в металле находятся примеси (соли, неметаллы, модификации углерода), то наблюдается ускоренная коррозия. Проверить это можно дома, опустив в соляной раствор (NaCl + H2O) металлическую деталь. Уже через сутки появится ржавчина.
Что такое коррозия?
Слово «коррозия» происходит от латинского «corrodo – грызу». Встречаются ссылки и на позднелатинское «corrosio – разъедание». Но так или иначе:
Хотя коррозию чаще всего связывают с металлами, ей также подвергаются бетон, камень, керамика, дерево, пластмассы. Применительно к полимерным материалам, правда, чаще используется термин деструкция или старение.
Коррозия и ржавчина — не одно и то же
В определении коррозии абзацем выше не зря выделено слово «процесс». Дело в том, коррозию частенько приравнивают к термину «ржавчина». Однако это не синонимы. Коррозия — это именно процесс, в то время как ржавчина — один из результатов этого процесса.
Также стоит отметить, что ржавчина — продукт коррозии исключительно железа и его сплавов (таких как сталь или чугун). Поэтому, когда говорим «ржавеет сталь», то подразумеваем, что ржавеет железо в ее составе.

Если ржавчина относится только к железу, значит другие металлы не ржавеют? Не ржавеют, но это не значит, что они не корродируют. Просто продукты коррозии у них другие.
Например, медь, корродируя, покрывается красивым по цвету зеленоватым налетом (патиной). Серебро на воздухе тускнеет — это на его поверхности образуется налет сульфида, чья тонкая пленка придает металлу характерную розоватую окраску.
 Патина — продукт коррозии меди и ее сплавов
Патина — продукт коррозии меди и ее сплавов
Механизм протекания коррозионных процессов
Разнообразие условий и сред, в которых протекают коррозионные процессы, очень широко, поэтому сложно дать единую классификацию встречающихся случаев коррозии. Но, несмотря на это, все коррозионные процессы имеют не только общий результат — разрушение металла, но и единую химическую сущность — окисление.
Упрощенно окисление можно назвать процессом обмена веществ электронами. Когда одно вещество окисляется (отдает электроны), другое, наоборот, восстанавливается (получает электроны).
Например, в реакции…
… атом цинка теряет два электрона (окисляется), а молекула хлора присоединяет их (восстанавливается).
Частицы, которые отдают электроны и окисляются, называются восстановителями, а частицы, которые принимают электроны и восстанавливаются, называются окислителями. Два этих процесса (окисление и восстановление) взаимосвязаны и всегда протекают одновременно.
Такие вот реакции, которые в химии называются окислительно-восстановительными, лежат в основе любого коррозионного процесса.
Склонность к окислению у разных металлов неодинакова. Чтобы понять, у каких она больше, а у каких меньше, вспомним школьный курс химии. Было там такое понятие как электрохимический ряд напряжений (активности) металлов, в котором все металлы расположены слева направо в порядке повышения «благородности».
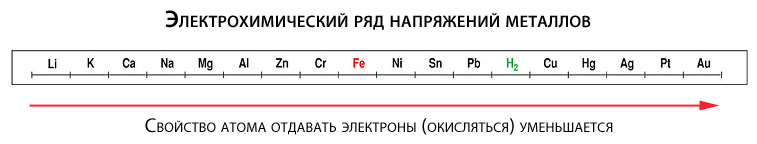
Так вот, металлы, расположенные в ряду левее, более склонны к отдаче электронов (а значит и к окислению), чем металлы, стоящие правее. Например, железо (Fe) больше подвержено окислению, чем более благородная медь (Cu). Отдельные металлы (например, золото), могут отдавать электроны только при определенных экстремальных условиях.
К ряду активности вернемся немного позже, а сейчас поговорим об основных видах коррозии.
Пути предотвращения коррозии металлов
1. Отбор правильного материала
Один из наиболее важных способов предотвращения коррозии металлов — правильный выбор материала. Некоторые металлы более устойчивы к коррозии, чем другие. Например, нержавеющая сталь и алюминий обладают высокой степенью коррозионной стойкости и могут использоваться в условиях, где металлы из других материалов не смогут продержаться надолго. Поэтому при проектировании и выборе материалов следует учесть условия эксплуатации и уровень коррозии в данном районе.
2. Регулярное обслуживание и контроль
Очень важно поддерживать регулярное обслуживание и контроль за металлическими конструкциями и оборудованием. Систематическое проведение инспекций и обслуживания позволяет выявлять и исправлять любые дефекты, повреждения или участки с потенциальной угрозой коррозии
Особое внимание следует обращать на труднодоступные места, где скапливание влаги и загрязнений может способствовать образованию коррозии
3. Применение защитных покрытий
Использование защитных покрытий — один из эффективных способов предотвращения коррозии металлов. Они создают барьер между металлом и окружающей средой, препятствуя воздействию кислорода и влаги. Различные типы покрытий могут быть использованы в зависимости от условий эксплуатации и требуемого уровня защиты. Некоторые из них включают краски, эмали, оксидные покрытия и цинковые покрытия.
4. Изолирование от влаги и агрессивных сред
Один из ключевых факторов коррозии — воздействие влаги и агрессивных сред
Поэтому важно предотвращать проникновение влаги в металлические конструкции и оборудование. Влагоотталкивающие материалы и уплотнители могут быть использованы для заполнения щелей и соединений, чтобы предотвратить проникновение влаги
Также рекомендуется установка защитных покрытий на внешние поверхности, чтобы предотвратить контакт с агрессивными средами, такими как химические реагенты или соли.
5. Поддержание правильного уровня окружающей среды
Уровень окружающей среды может существенно влиять на скорость коррозии металлов. Например, высокая влажность, наличие солей и химических веществ в воздухе или почве может способствовать образованию коррозии
Поэтому важно поддерживать правильные условия в окружающей среде, например, путем контроля влажности и очистки воздуха от загрязнений. Это поможет значительно уменьшить риск коррозии и продлить срок службы металлических конструкций и оборудования
ВОДОРОДНАЯ И ГАЛОГЕНИДНАЯ КОРРОЗИЯ
Водородная коррозия возникает при диффузии водорода в сталь и другие материалы при высоких температурах, что наблюдается, например, в аппаратуре для синтеза аммиака или переработки метана. Она вызывает изменение механических свойств металлов: повышение хрупкости стали, ее расслоение и пузырение. Хрупкое разрушение при водородной коррозии в большей степени характерно для высокоуглеродистой стали, имеющей высокие прочностные показатели, тогда как для мягких сталей типично расслоение и пузырение.
Учитывая, что метан при определенных условиях легко разделяется на углерод и водород, водородная коррозия может возникать в аппаратах и сосудах, работающих под давлением с природными и попутными нефтяными газами. Метан собирается в отдельных пустотах, трещинах, дефектах металла, вызывая внутренние напряжения, из-за которых приходится снижать рабочие нагрузки на детали. В результате в мягких сталях возникают пузыри, и металл расслаивается, а высокопрочные стали при относительно небольших механических нагрузках подвергаются хрупкому разрушению.
Медь, а также некоторые ее сплавы могут быть склонны к водородной коррозии в тех случаях, когда недостаточно глубоко проведено их раскисление в процессе металлургического производства, то есть когда в металле сохранился кислород, например, в виде закиси меди Cu2O. Этот оксид образует отдельную фазу в металле, а проникающий в металл водород, химически взаимодействуя с ним, восстанавливает его. Образуется водяной пар, который при высокой температуре может быть причиной возникновения хрупкости меди.
Все это следует принимать во внимание при использовании порошковых материалов для изготовления центробежных колес и управляющих аппаратов ЭЦН, которые во многих случаях не выдерживают условий эксплуатации, и это связано как раз с возникновением хрупкости меди, которая используется в порошковых ступенях как связующий материал. В результате ухудшается работа направляющих аппаратов и рабочих колес, в них возникают зоны, которые промываются потоком пластовой жидкости
Некоторые металлы, например титан, способны поглощать (абсорбировать) большие количества кислорода при высокой температуре. Если такой металл оказывается затем в контакте с водородом, то также может наблюдаться водородная коррозия, снижающая его прочность
Учитывая, что многие аппараты, работающие под давлением, изготовлены из стали типа 09Х13Н2Т, где содержится до 1,5% титана, следует обязательно принимать во внимание вопросы температурного напряжения и, соответственно, контакта со свободным водородом и кислородом титана, который используется для изготовления этих видов оборудования
Галогенидная коррозия представляет собой процесс коррозии металлов в хлористом водороде, хлоре, фторе, броме, йоде с образованием галогенидов. Обычно при низких температурах большинство металлов слабо взаимодействует с такими веществами, но при температурах 200–300°С происходит самоускорение этих реакций, и некоторые металлы буквально «сгорают». Это нужно помнить при разработке месторождений, в пластовой воде которых содержится значительное количество галогенов. При воздействии на пласт термическими способами, при откачке жидкости с помощью центробежных насосов, температура может достигать величины, при которой возникает галогенидная коррозия.
Коррозия металлов: основные причины и факторы влияния
1. Химические реакции: Взаимодействие металлов с окружающей средой является одной из основных причин коррозии. Неравновесие между металлом и его окружением вызывает химические реакции, приводящие к разрушению металлической поверхности. Например, окисление железа при контакте с кислородом воздуха приводит к образованию ржавчины.
2. Электрохимические процессы: Пары металла и околоагрессивная среда (например, влага) образуют электролитическую систему, в которой происходит процесс электрохимической коррозии. Разность потенциалов между различными участками металла приводит к выделению ионов металла, что приводит к разрушению поверхности. Примером явления электрохимической коррозии является коррозия железа в присутствии влаги и кислорода.
3. Воздействие агрессивных сред: Наличие в окружающей среде веществ, способных разрушать металлы, таких как кислоты, соли или алкалии, является еще одной причиной коррозии. Например, гидроксид натрия, содержащийся в отмывочных средствах, может вызывать коррозию алюминия.
4. Механическое воздействие: Механическое воздействие, такое как трение, удары или вибрация, может вызвать облегченную коррозию металлов. Повреждение поверхности металла может создать новые участки, которые подвержены более интенсивной коррозии.
5. Присутствие микроорганизмов: Вода и почва могут содержать бактерии и грибки, которые способны разрушать металлы. Присутствие этих микроорганизмов влечет за собой коррозию металлов и нарушение их структуры.
В целом, коррозия металлов является сложным процессом, вызванным взаимодействием различных факторов. Понимание основных причин и факторов коррозии позволяет разработать эффективные методы предотвращения и защиты от этого нежелательного явления.
Есть ли надежда?
Ущерб, наносимый человечеству коррозией, колоссален. По разным данным коррозия «съедает» от 10 до 25% мировой добычи железа. Превращаясь в бурый порошок, оно безвозвратно рассеивается по белу свету, в результате чего не только мы, но и наши потомки остаемся без этого ценнейшего материала.
Но беда не только в том, что теряется металл как таковой, нет — разрушаются мосты, машины, крыши, памятники архитектуры. Коррозия не щадит ничего.
Неизлечимо больна та же Эйфелева башня — символ Парижа. Изготовленная из обычной стали, она неизбежно ржавеет и разрушается. Башню приходится красить каждые 7 лет, отчего ее масса каждый раз увеличивается на 60-70 тонн.

К сожалению, полностью предотвратить коррозию металлов невозможно. Ну, разве что полностью изолировать металл от окружающей среды, например поместить в вакуум. Но какой смысл от таких «консервированных» деталей? Металл должен работать. Поэтому единственным способом защиты от коррозии является поиск путей ее замедления.
В незапамятные времена для этого применяли жир, масла, позднее начали покрывать железо другими металлами. Прежде всего, легкоплавким оловом. В трудах древнегреческого историка Геродота (V в. до н.э.) и римского ученого Плиния-старшего уже есть упоминания о применении олова для защиты железа от коррозии.
Интересный случай произошел в 1965 году на Международном симпозиуме по борьбе с коррозией. Некий индийский ученый рассказал об обществе по борьбе с коррозией, которое существует около 1600 лет и членом которого он является. Так вот, полторы тысячи лет назад это общество принимало участие в постройке храмов Солнца на побережье у Конарака. И несмотря на то, что эти храмы некоторое время были затоплены морем, железные балки прекрасно сохранились. Так что и в те далекие времена люди знали толк в борьбе с коррозией. Может быть, не все так безнадежно?



![§ 79. коррозия металлов [1971 ходаков ю.в., эпштейн д.а., глориозов п.а. - неорганическая химия. учебник для 9 класса]](http://fest62.ru/wp-content/uploads/8/1/f/81f9494b00949c20868250c7e720dba0.jpeg)


























